Selected Publications
(# Co-first author; * Corresponding author)
Published as correspondence/co-correspondence author
Bo Li#, Ting Li#, Dingjie Wang#, Ying Yang, Puwen Tan, Yunhao Wang, Yun-Gui Yang*, Shunji Jia*, Kin Fai Au*. Zygotic activation of transposable elements during zebrafish early embryogenesis. Nat Commun. 2025.
Ting Li#, Tursunjan Aziz, Guangyuan Li, Lin Zhang, Jihua Yao*, Shunji Jia*. A zebrafish tufm mutant model for the COXPD4 syndrome of aberrant mitochondrial function. Journal of Genetics and Genomics. 2024.
Shihui Ding#, Tursunjan Aziz, Anming Meng, Shunji Jia*. Aagab is required for zebrafish larval development by regulating neural activity. Journal of Genetics and Genomics. 2024.
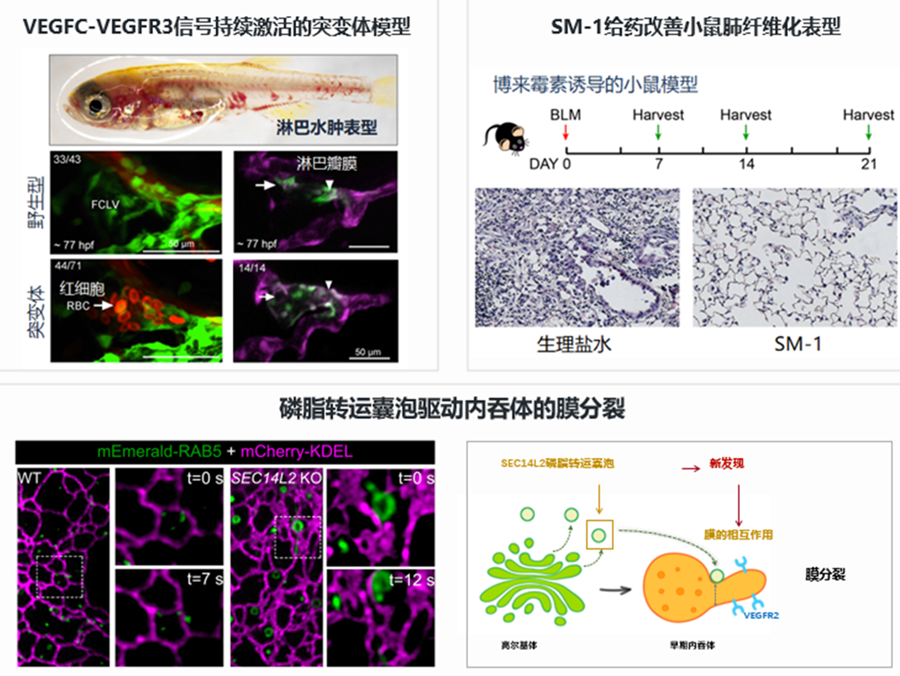
Yaping Meng#, Tong Lv#, Junfeng Zhang, Weimin Shen, Lifang Li, Yaqi Li, Xin Liu, Xing Lei, Xuguang Lin, Hanfang Xu, Anming Meng*, Shunji Jia*. Temporospatial inhibition of Erk signaling is required for lymphatic valve formation. Signal Transduct Target Ther. 2023.
Bo Gong#, Yuting Guo#, Shihui Ding, Xiaohui Liu, Anming Meng , Dong Li*, Shunji Jia*. A Golgi-derived vesicle potentiates PI4P to PI3P conversion for endosome fission. Nat Cell Biol, 2021.
Shunji Jia*, Anming Meng*. TGFβ family signaling during embryonic development. Development, 2021.
Bo Gong, Zhihao Li, Wanghua Xiao, Guangyuan Li, Shihui Ding, Anming Meng*, Shunji Jia*. Sec14l3 potentiates VEGFR2 signaling to regulate zebrafish vasculogenesis. Nat Commun, 2019.
Yixia Wang, Yanchao Han, Pengfei Xu, Shihui Ding, Guangyuan Li, Hongbin Jin, Yaping Meng, Anming Meng, Shunji Jia*. prpf4 is essential for cell survival and posterior lateral line primordium migration in zebrafish. Journal of Genetics and Genomics, 2018.
Bo Gong, Weimin Shen, Wanghua Xiao, Yaping Meng, Anming Meng, Shunji Jia*. The Sec14-like phosphatidylinositol transfer proteins Sec14l3/SEC14L2 act as GTPase proteins to mediate Wnt/Ca2+ signaling. Elife, 2017.
Qingrui Sun#, Xingfeng Liu#, Bo Gong, Di Wu, Anming Meng, Shunji Jia*. Alkbh4 and Atrn Act Maternally to Regulate Zebrafish Epiboly. Int J Biol Sci, 2017.
Cencan Xing, Bo Gong, Yu Xue, Yanchao Han, Yixia Wang, Anming Meng*, Shunji Jia*. TGFβ1a regulates zebrafish posterior lateral line formation via Smad5 mediated pathway. J Mol Cell Biol, 2015.
Shunji Jia#, Fangyan Dai#, Di Wu, Xia Lin, Cencan Xing, Yu Xue, Ying Wang, Mu Xiao, Wei Wu, XinHua Feng*, Anming Meng*. Protein Phosphatase 4 Cooperates with Smads to Promote BMP Signaling in Dorsoventral Patterning of Zebrafish Embryos, Dev Cell, 2012.
Yu Cui, Shan He, Cencan Xing, Kefeng Lu, Jian Wang, Guichun Xing, Anming Meng, Shunji Jia*, Fuchu He*, Lingqiang Zhang*. SCFFBXL15 regulates BMP signalling by directing the degradation of HECT-type ubiquitin ligase Smurf1. EMBO J, 2011.
Laixin Xia#, Shunji Jia#, Shoujun Huang#, Hailong Wang, Yuanxiang Zhu, Yanjun Mu, Lijuan Kan, Wenjing Zheng, Di Wu, Xiaoming Li, Qinmiao Sun, Anming Meng, Dahua Chen*.The Fused/Smurf Complex Controls the Fate of Drosophila Germline Stem Cells by Generating a Gradient BMP Response. Cell, 2010.
Shunji Jia*, Di Wu, Cencan Xing, Anming Meng*. Smad2/3 activities are required for induction and patterning of the neuroectoderm in zebrafish. Dev Biol, 2009.
Shunji Jia, Zhen Ren, Xiang Li, Ying Zheng, Anming Meng*. smad2 and smad3 are required for mesendoderm induction by transforming growth factor-beta/Nodal signals in zebrafish. J Biol Chem, 2008.
Shunji Jia*, Anming Meng*. Tob genes in development and homeostasis. Dev Dyn, 2007.
Huizhe Huang#, Fu-I Lu#, Shunji Jia#, Shu Meng, Ying Cao, Yeqi Wang, Weiping Ma, Kun Yin, Zilong Wen, Jingrong Peng, Christine Thisse, Bernard Thisse*, Anming Meng*. Amotl2 is essential for cell movements in zebrafish embryo and regulates c-Src translocation. Development, 2007.