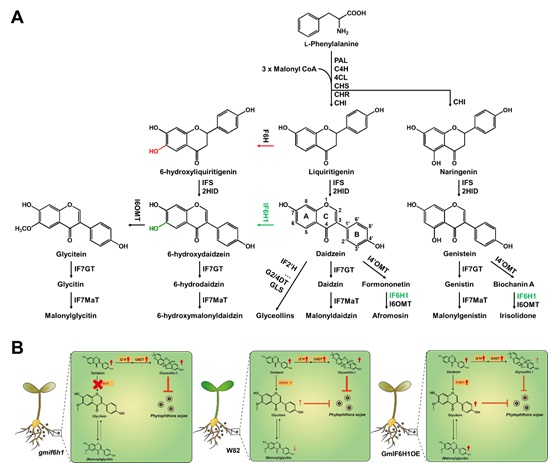
大豆作为重要的粮食作物和经济作物,其种子中富含的异黄酮类化合物不仅对人体健康有益,还在植物防御病原体过程中发挥关键作用。其中,glycitein型异黄酮因其独特的生物活性备受关注。然而,其生物合成途径长期存在争议,尤其是催化关键反应步骤的酶一直未被明确。尽管已有研究推测glycitein可能来源于黄烷酮6-羟基化途径,但其确切合成路线及生理功能始终缺乏直接实验证据。
针对这一科学难题,中国科学院遗传与发育生物学研究所王国栋研究组通过代谢组-全基因组关联分析(mGWAS),在大豆自然群体中鉴定到一个细胞色素P450基因GmIF6H1(原名GmCYP76F17)。结合酵母异源表达、生化实验和稳定同位素标记技术,研究团队首次证实GmIF6H1特异性催化大豆苷元(daidzein)的A环6-羟基化反应,生成6-羟基大豆苷元,进而通过甲基化形成glycitein。该发现颠覆了以黄烷酮为前体的传统模型,建立了以daidzein为核心前体的全新生物合成途径。进一步研究显示,GmIF6H1第248位氨基酸的苏氨酸/丙氨酸替换(T248A)显著影响酶活性,且该位点在大豆驯化过程中被选择,导致栽培种中glycitein含量降低。
机制研究表明,glycitein型异黄酮与glyceollins(通过大豆苷元2'-羟基化生成)在大豆抵御疫霉(Phytophthora sojae)感染时发挥协同作用。正常条件下,glycitein作为“植物先天抗菌素”(phytoanticipin)提前积累;病原侵染后,glyceollins作为“植物抗毒素”(phytoalexin)被诱导合成。值得注意的是,无论敲除还是过表达GmIF6H1,均会导致大豆对疫霉病的抗性下降:敲除突变体因glycitein缺失而防御能力减弱,而过表达株系则因代谢流重新分配抑制了glyceollin的合成。该结果揭示了大豆通过精细调控异黄酮分支代谢实现防御效益最大化的平衡机制。
该研究不仅阐明了glycitein的生物合成起源及其在植物免疫中的功能,也为大豆抗病分子育种提供了新的靶基因。通过精准调控GmIF6H1的表达水平,有望培育出异黄酮组分优化、抗疫霉病能力增强的大豆品种,从而提升作物的可持续生产潜力。下一步,研究团队将结合合成生物学策略,设计兼具营养健康价值与抗逆性的“智能大豆”。
相关研究成果以A Balance between Glycitein and Glyceollins Governed by Isoflavone 6-Hydroxylase Confers Soybean Resistance to Phytophthora sojae为题,发表于PNAS杂志(2025,122:e2525627122)。杨麒麟博士为论文第一作者,王国栋研究员为通讯作者。该研究得到崖州湾国家实验室田志喜研究员,中国科学院遗传发育所李磊研究员,中国农业科学院生物技术研究所林浩研究员和上海辰山植物园李建戌副研究员的大力帮助,并获得农业农村部重大专项、国家重点研发计划、中国科学院战略性前沿重点研究计划以及国家自然科学基金的资助。
大豆异黄酮代谢途径新成员GmIF6H1调控抗疫霉病的机制解析