田烨研究组与希伯来大学Ehud Cohen团队合作应邀在Trends in Cell Biology撰写观点文章“TGF-β信号通路:跨组织调控蛋白质稳态的新视角”
维持蛋白质稳态(proteostasis)依赖细胞内多种机制协同作用。然而,随着衰老、基因突变或环境应激的累积,错误折叠的蛋白质可能逃避免疫监控并发生聚集,从而诱发神经退行性疾病等蛋白质聚集病。长期以来,蛋白稳态维持被视为细胞自主的过程,但近年研究发现,不同组织间的信号传递在全身蛋白质稳态调控中发挥重要作用。
2025年8月29日,中国科学院遗传与发育生物学研究所田烨研究组与希伯来大学Ehud Cohen团队合作在Trends in Cell Biology杂志在线发表研究文章TGF-β signaling as an organismal proteostasis regulator(DOI:10.1016/j.tcb.2025.07.008)。该文章评述了TGF-β信号在协调蛋白稳态方面的作用及其保守性,并探讨其潜在的转化意义。
细胞和机体的健康依赖蛋白质组的完整性。蛋白质稳态网络(proteostasis network, PN)通过协同机制,确保新生多肽正确折叠并维持成熟蛋白的稳定。生命早期,PN运行高效;但随着年龄增长、大量错误折叠蛋白质会使PN超负荷,形成难以清除的毒性蛋白聚集体。这一失衡过程与阿尔茨海默病(AD)、亨廷顿舞蹈症(HD)等多种晚发性神经退行性疾病密切相关。
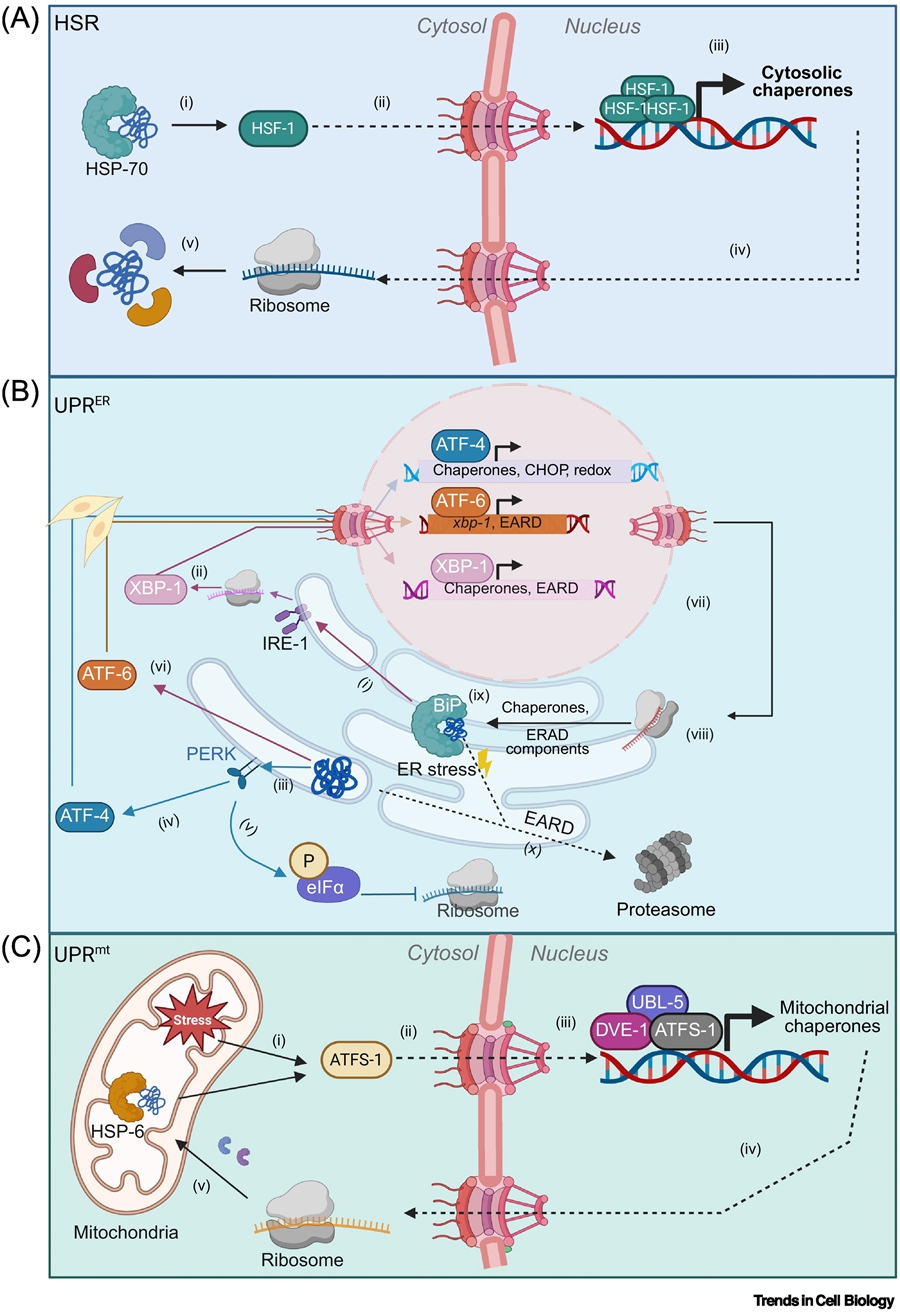
针对蛋白质折叠压力,细胞内不同细胞器演化出了特定的应激反应通路如热休克反应(HSR),内质网未折叠蛋白反应(UPRER),线粒体未折叠蛋白反应(UPRmt)。这些应激反应主要在细胞水平运作(图1)。
越来越多研究发现,蛋白质稳态并非仅靠细胞自身调节,不同组织之间也能通过信号通路相互影响。其中,TGF-β信号通路发挥着核心作用。
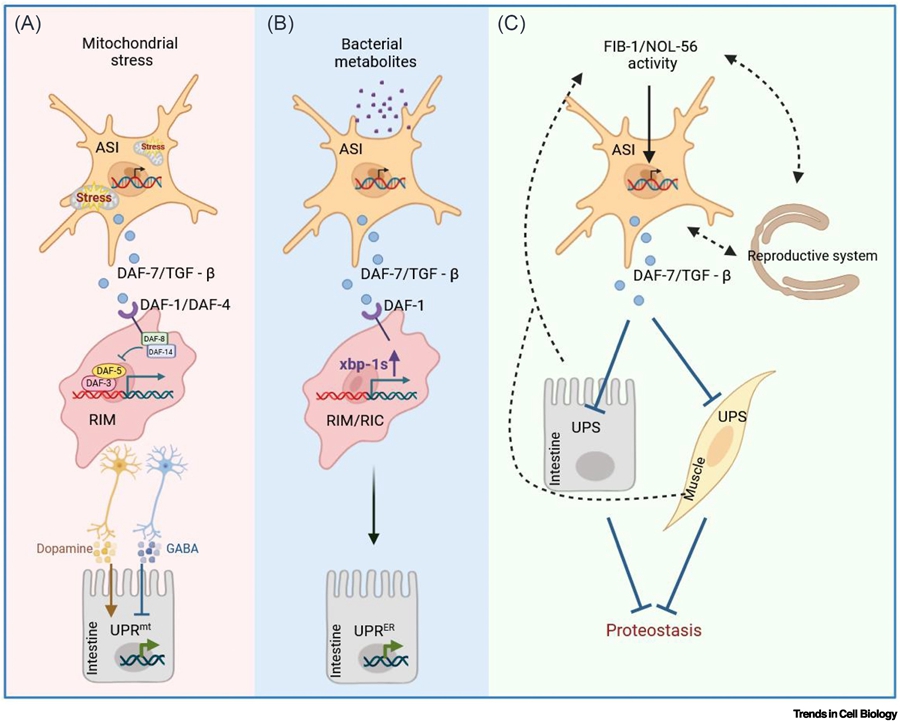
在模式生物秀丽隐杆线虫中,ASI感觉神经元感知线粒体应激后,分泌TGF-β配体DAF-7,通过与RIM中间神经元上的DAF-1/DAF-4受体结合,激活DAF-3/DAF-5转录复合物,进而启动肠道UPR。ASI感觉神经元感知线粒体应激后,分泌TGF-β配体DAF-7,通过与RIM中间神经元上的DAF-1/DAF-4受体结合,激活DAF-3/DAF-5转录复合物,进而启动肠道UPRmt,提升全身应激抵抗力并延长寿命(图2)。
TGF-β信号通路在病原感知诱导肠道UPRER的过程中也发挥着重要作用。神经元感知有害细菌代谢产物后,通过TGF-β依赖途径激活肠道UPRER。缺失TGF-β受体时,这一反应显著减弱(图2)。
TGF-β 信号的抑制并不总是有害,反之,其激活也并非必然有益。新近研究发现,抑制核仁因子复合体(FIB-1/NOL-56)可通过另一条TGF-β通路增强对毒性蛋白聚集体的抵抗(图2)。具体来说,核仁甲基转移酶复合物(FIB-1/NOL-56)通过抑制TGF-β活性解除对DAF-3转录因子的抑制,进而激活HSF-1并增强UPS功能,最终缓解Aβ/polyQ蛋白毒性。这一机制揭示核仁-TGF-β-HSF-1轴可能成为干预蛋白病的新靶点。
TGF-β信号在哺乳动物中同样参与蛋白质稳态调控,但其作用具有情境和组织依赖性:过度激活可加速肌肉蛋白降解,引发肌肉萎缩与衰老。在肿瘤细胞中,TGF-β可诱导自噬降解蛋白;在成纤维细胞中,其活性又受自噬调节。人类细胞中,TGF-β参与细胞外基质重塑、线粒体碎片化及UPRmt激活。这些发现表明,机体能够根据不同的环境和组织背景,有选择地激活必要的TGF-β信号通路以维持蛋白质稳态,同时抑制不必要的反应。
TGF-β信号通路作为蛋白质稳态的核心调控节点,揭示了机体在应对蛋白质折叠压力时的跨组织通信机制。这为治疗蛋白质聚集相关疾病提供了新的思路。未来的关键问题在于:哪些具体“信使”分子介导了TGF-β信号从神经元到外周组织的传递?这些信号分子可能包括神经递质、神经肽或未知因子。一旦这些分子被识别出来,并阐明其作用机制,就有望开发出增强蛋白质稳态、延缓相关疾病进程的新干预策略。
希伯来大学Ehud Cohen团队的博士生朱华栋为该文章的第一作者,
中国科学院遗传发育所博士后张茜为第二作者参与该文章,希伯来大学Ehud Cohen研究员和中国科学院遗传发育所田烨研究员为该论文的共同通讯作者。该工作得到了国家重点研发计划、国家自然科学基金委项目、中国科学院稳定支持基础研究领域青年团队计划和新基石科学基金会等资助。