艾有为研究组在小分子化合物激活PDE3A-SLFN12通路介导细胞死亡研究中取得新进展
发布时间:2022.02.07
开发安全有效的小分子药物用于癌症治疗仍然是抗癌药物研发中的重要一环。癌细胞具有有别于正常细胞的特征,癌细胞依赖于这些特征而恶化、增殖、扩散。基于这些有别于正常细胞的“癌细胞特征”开发小分子药物在帮助杀伤癌细胞的同时,减少了给健康细胞带来毒副作用。
先前哈佛大学/MIT的研究人员基于小分子化合物高通量筛选技术发现小分子DNMDP通过结合磷酸二酯酶PDE3A,诱导PDE3A与一个功能研究甚少的SLFN12蛋白相互作用,激活了癌细胞的细胞凋亡(DOI:10.1038/nchembio.198)。NIBS研究人员(艾有为博士为主要研究人员之一)结合化合物高通量筛选技术与全基因组CRISPR-Cas9 survival screen独立报导雌二醇(17-b-estradiol)与Nauclea subdita树皮中分离的多环吲哚生物碱(nauclefine)结合PDE3A,招募SLFN12形成复合物,来稳定快速降解的SLFN12蛋白,细胞内SLFN12蛋白水平升高足以造成细胞凋亡发生(https://doi.org/10.1016/j.molcel.2019.06.040 )、(https://doi.org/10.1038/s41467-020-17052-4 )。
中国科学院遗传与发育生物学研究所艾有为研究组当前研究表明,多个化学结构截然不同的小分子化合物,通过分子胶水的方式诱导PDE3A与SLFN12形成复合物。这个PDE3A-分子胶水-SLFN12的复合物一方面稳定了细胞浆中SLFN12的蛋白含量,另一方面促进SLFN12包括Serine368和Serine573位点的去磷酸化修饰。进一步研究发现,无论是增加SLFN12在细胞浆当中的蛋白含量,还是SLFN12的去磷酸化修饰,均促进细胞死亡的发生,且两者具有“平行、叠加”的作用效果。机理上,细胞浆当中去磷酸化修饰的SLFN12蛋白含量的增加激活SLFN12的核酸内切酶活性,造成18S/28S rRNA在内的RNA降解,进而导致细胞死亡。突变SLFN12的核酸内切酶活性关键氨基酸抑制了去磷酸化的SLFN12介导的细胞死亡。因此,本工作进一步揭示了小分子化合物诱导PDE3A-SLFN12依赖的细胞死亡的生化机理(图)。由于当前研究表明PDE3A和SLFN12同时高表达仅在一些癌细胞类型中被检测到,而在人体健康组织中很少检测到,本工作提示PDE3A和SLFN12的分子胶水有潜力用于癌细胞中PDE3A和SLFN12高表达的病人的抗癌治疗。
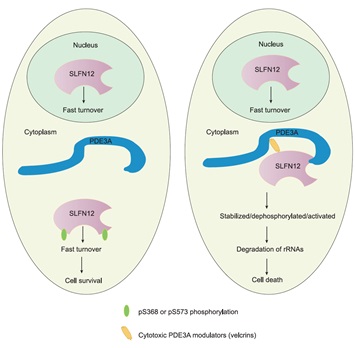
图:分子胶水介导PDE3A-SLFN12依赖的细胞死亡的生化机理
该研究以“Multiple PDE3A modulators act as molecular glues promoting PDE3A–SLFN12 interaction and induce SLFN12 dephosphorylation and cell death”为题于2022年1月31日在线发表于Cell Chemical Biology杂志上(DOI:10.1016/j.chembiol.2022.01.006)。闫博博士为该论文第一作者,艾有为研究员为论文通讯作者。该工作得到中科院遗传发育所与分子发育生物学国家重点实验室经费支持,同时得到NIBS科研人员的支持与帮助(北京市与科技部项目)。