黄勋研究组揭示Cds2调节线粒体磷脂含量和线粒体功能影响非酒精性肝炎NASH的快速发生
发布时间:2021.12.06
非酒精性脂肪肝(NAFLD)包括一系列肝损伤,从单纯脂肪变性到非酒精性肝炎(NASH),后者可发展为肝硬化和肝癌(HCC)。目前NAFLD全球患病率高达25%,中国患病人口超过2.5亿,且缺乏有效治疗药物,造成重大社会负担。除非存在继发性饮食或化学肝毒性损伤,常用的遗传小鼠模型不会自发进展到肝纤维化、硬化和肝癌。因此,创造严重疾病表型(如纤维化和HCC)快速进展的遗传模型,对理解该疾病的发病致病机制以及评估抗NASH和抗纤维化候选药物的治疗潜力巨大。
在磷脂合成途径中,磷脂酸(PA)可作为甘油三酯和磷脂酰肌醇(PI)的共同前体,其下游的代谢调控决定了脂类代谢的流向。中国科学院遗传与发育生物学研究所黄勋实验室前期研究发现胞嘧啶二脂酰甘油合成酶(CDP-DAG synthase, CDS)将磷脂酸(PA)从合成甘油三酯转到合成磷脂酰肌醇,调控脂类存贮过程向胰岛素信号通路介导的细胞生长过程的转化(Liu et al, PLoS Genetics, 2014)。黄勋实验室最新的研究发现小鼠CDS2水平在遗传或饮食诱导的NAFLD模型中下调。CDS2的肝脏特异性缺失引起NASH快速发生:五周龄小鼠即出现肝脏脂肪变性、炎症和纤维化。机制上,CDS2在介导内质网-线粒体间脂类运输的线粒体相关膜(MAM)上有定位,且肝脏Cds2缺失会损害线粒体功能并降低线粒体磷脂酰丝氨酸(PS)和磷脂酰乙醇胺(PE)水平。过表达线粒体PE合成酶PISD可减轻肝脏Cds2缺失小鼠的NASH样表型以及肝细胞中CDS2缺失引起的线粒体形态和功能异常。此外,饮食补充增强线粒体功能的PPARα激动剂也可减轻肝脏Cds2缺失小鼠线粒体缺陷,并改善NASH样表型。CDS2过表达可以防止高脂饮食引起的肝脂肪变性和肥胖。本研究为Cds2在维持线粒体形态、脂质组成和功能中的作用提供了证据,并提供了一个不需要二次饮食或化学肝毒性损伤的体内模型,为获得从脂肪变性到NASH和纤维化转变的机制研究提供新见解(Xu et al., Science Bulletin, In press)。
在CDS2的调控方面,黄勋实验室研究人员参与澳大利亚新南威尔士大学Hongyuan Yang团队的工作中发现AGPAT2(1-酰基甘油-3-磷酸 O-酰基转移酶-2)和CDS1/2可以直接相互作用并形成功能复合物。AGPAT2缺失降低了CDS蛋白的稳定性,并导致细胞系和小鼠肝脏中的CDS活性下降。肝脏AGPAT2缺失也会造成肝脏CDS2缺失类似的脂肪变性的表型。这部分工作为磷脂合成途径中关键分支的代谢通量调节提供了新的分子见解(Mak et al., Nature Communications, 2021)。
上述研究成果得到了研究所内外多个实验室的支持,黄勋研究组助理研究员许捷思与博士生陈思宇为《Science Bulletin》论文的共同第一作者,许捷思为共同通讯作者。这部分研究得到国家科技部项目和国家自然科学基金项目的资助。
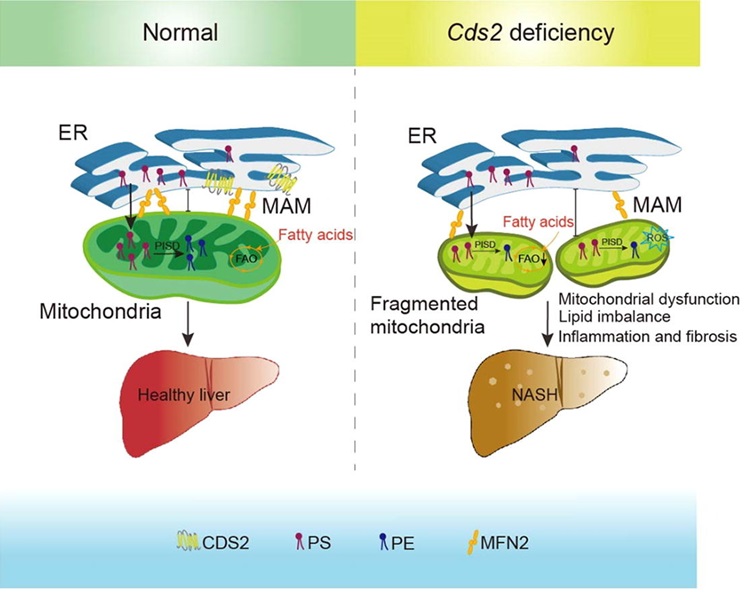
图1:Cds2缺乏促进NASH发展的可能机制(Xu et al., Science Bulletin, In press)
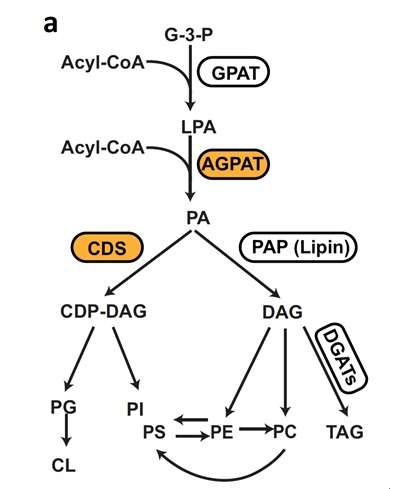
图2:CDS和AGPAT共同调控磷脂合成途径中磷脂酸的代谢通量
(Mak et al., Nature Communications, 2021)